2017年4月28日,中国科学院生物物理研究所研究员柳振峰博士应我校LifeScience Research Seminar邀请,为师生做了题为“新型通道膜蛋白的结构与门控机制”的学术报告。
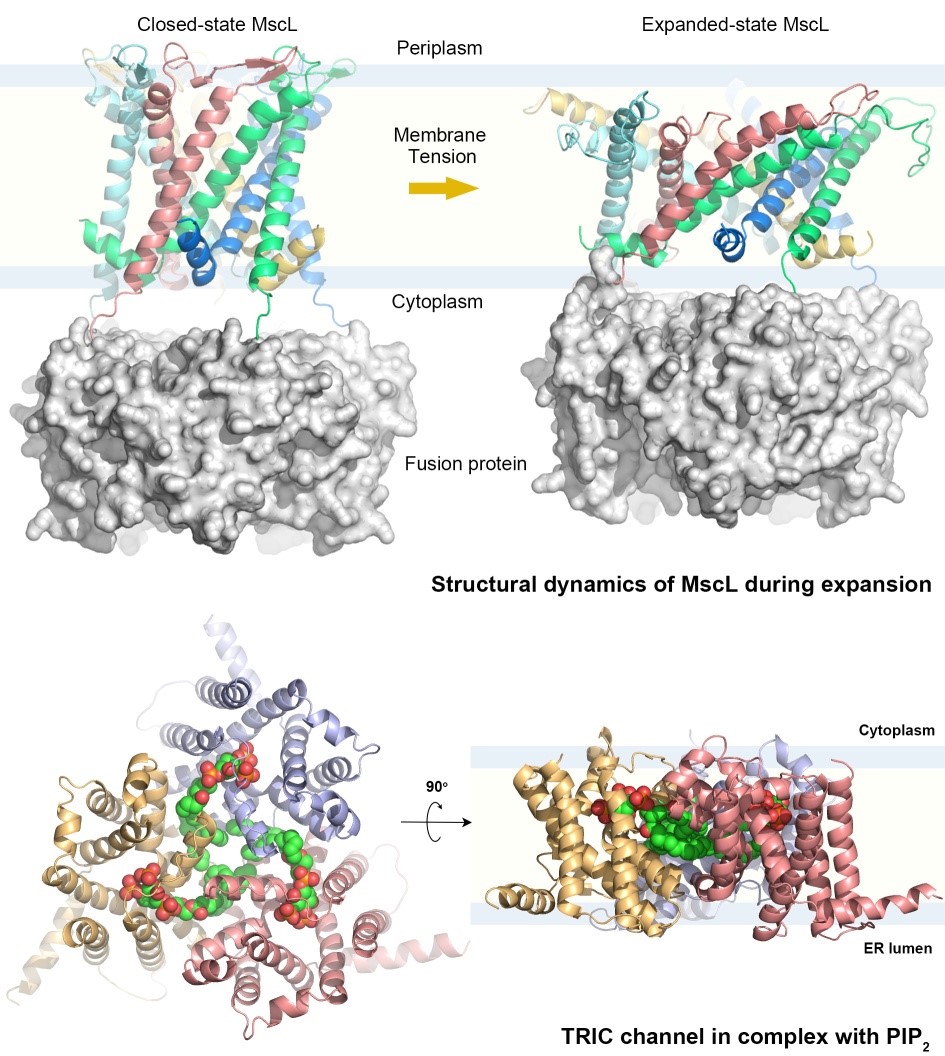
渗透压的变化、重力以及声波等物理因素会给细胞带来机械力的刺激。细菌、植物以及动物细胞通过被称为机械力感应(mechanosensation)的跨膜信号转导过程来实现对于机械力信号的探测和响应。在微生物中发挥机械力感应作用的大电导机械力敏感通道(MscL)是位于细菌质膜上的一种被称为“减压阀”的通道膜蛋白。在低渗环境的刺激下,MscL感应胞内膨胀压导致的膜内张力,发生构象变化并打开~30?宽的孔道,快速释放胞内的压力而使细菌细胞免受裂解。刘振峰团队通过结构生物学的方法研究了MscL扩展过程中的结构动态变化规律,发现了其各部件之间的偶联原理,并探讨了该通道所介导的机械力跨膜转导的分子机制(Proc.Natl.Acad.Sci.,2015)。在动物细胞中,机械力和其它信号跨膜转导后的胞内级联信号传递过程由Ca2+离子等信使介导。三聚态胞内阳离子通道(TRIC通道)是位于内质网和肌浆网上的一种与Ca2+从胞内钙库释放有关的单价阳离子通道,参与肌肉收缩和骨质形成的过程。他们通过研究秀丽线虫TRIC通道的结构与功能,首次揭示了该家族通道新颖的孔道组成,并提出了由磷脂酰肌醇4,5-二磷酸(PIP2)分子介导的门控机制模型(Nature, 2016)。围绕MscL和TRIC通道的系列研究结果拓展了人们对于这些新型通道膜蛋白的结构动态、孔道组成和门控机制的认识。
【柳振峰简介】
柳振峰,1998年获厦门大学生物学系生物学专业理学学士学位;2004年取得中国科学院生物物理研究所理学博士学位;2004年-2010年于加州理工学院/霍华德休斯医学研究所Douglas Rees实验室进行博士后工作研究,工作围绕细菌高通量机械力敏感通道(MscL)的结构与功能开展;2011年至今于中国科学院生物物理研究所组建膜蛋白结构生物学实验室,研究方向涉及光合作用状态转换相关膜蛋白复合物,机械力感受相关通道膜蛋白和脂类合成相关膜蛋白的结构与功能研究。



