我校生命学院孙博教授课题组与康奈尔大学/霍华德休斯医学研究所Michelle D. Wang教授课题组以噬菌体T7复制体为研究模型,使用单分子光镊技术揭示了复制体(replisome)在暂停DNA复制后,利用下游RNA转录体重启复制的新机制。北京时间2018年6月13日,相关成果以“Helicase Promotes Replication Re-initiation from an RNA transcript”为题,在知名学术期刊《自然-通讯》(Nature Communications)上在线发表。
DNA作为遗传信息的载体,通过半保留复制将信息由亲代传递给子代。该复制过程由解旋酶(helicase)、DNA聚合酶(DNA polymerase)等多个次级元件组成的复杂复制分子机器——复制体来执行完成。DNA损伤、高级结构以及DNA结合蛋白等复制模板上的障碍物(obstacles)往往会造成复制叉的暂停甚至崩溃,从而导致细胞死亡。为了保证实时准确的DNA复制,复制体必须有效克服位于模板上的多种障碍物,目前已发现了复制体克服障碍的多种路径。
孙博教授长期从事DNA复制体克服损伤以及重启复制的机制研究,前期与合作者已报道了一种复制体直接克服损伤的DNA复制重启机制—— 与DNA损伤相遇后,复制体中的解旋酶可以帮助DNA聚合酶以损伤DNA为模板进行复制,从而直接克服DNA损伤(Sun et al., Nat Commun, 2015)。但是,该路径只能帮助不到30%的复制体克服损伤,而其余超过70%的复制体并没有在损伤位置完全瓦解,而是继续解旋。这暗示在损伤下游可能存在其它类型的DNA复制重启机制。
基于以上猜想,研究人员设计了单分子光镊实验观测非复制状态下的复制体与同向暂停的RNA聚合酶(RNApolymerase)相遇碰撞结果。在这项最新的报道中,研究人员发现解旋酶与非复制态下的DNA聚合酶在复制叉位置有直接的相互作用,并共同前进解旋;同时,DNA聚合酶的存在可以帮助解旋酶快速长距解旋。此外,在解旋酶的帮助下,DNA聚合酶与同向RNA聚合酶相遇后,可以有效将RNA聚合酶移除,并利用RNA转录体为引物重启复制。基于以上结果,研究人员提出了一种新型的克服损伤的复制重启机制。在该重启机制中,复制体“聪明地”利用移除DNA结合蛋白来完成克服DNA损伤,一石二鸟。该工作不仅体现了解旋酶在复制过程中除解旋双链DNA外的多种功能角色,也为理解转录如何帮助复制体在复制起点(origins)启动复制的工作机制提供了线索。
该论文中,孙博教授为本论文的第一作者及共同通讯作者。该项研究得到了科技部、上海市科委以及上科大科研启动基金的支持。
论文链接:https://www.nature.com/articles/s41467-018-04702-x
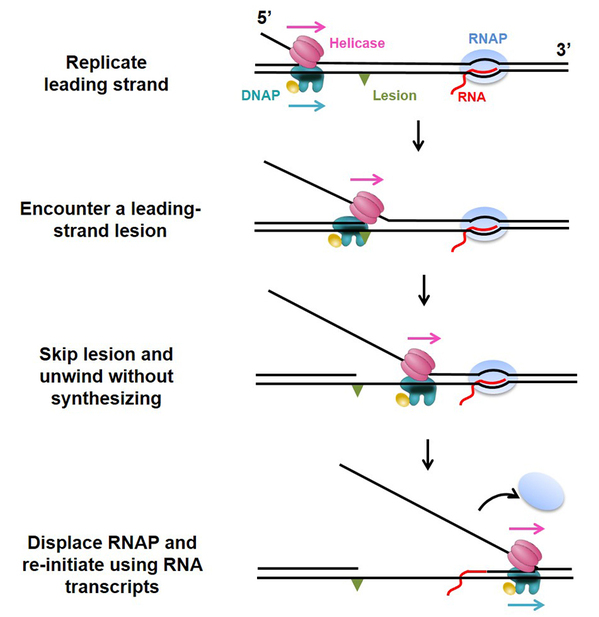
复制体利用RNA转录体为引物克服损伤重启复制


