近期,我校生命学院助理教授廖军研究组与美国国立卫生研究院José D. Faraldo-Gómez研究组、德克萨斯大学西南医学中心姜有星研究组合作,在国际一流学术期刊《Nature Structural and Molecular Biology》(2015年影响因子13.338)上发表了题为“Mechanism of extracellular ion exchange and binding-site occlusion in a sodium/calcium exchanger”的研究论文,阐明了钠钙交换体(sodium calcium exchanger, NCX)处于朝外状态时的离子交换与结合位点闭合的分子机制。廖军为本论文共同第一作者和共同通讯作者,上科大生命学院为第一单位。
钠钙交换体广泛分布于各类细胞上,具有反向转运钙离子(Ca2+)和钠离子(Na+)的功能,是调节胞质内钙稳态最重要的继发性主动转运蛋白之一。它在兴奋型细胞中参与一系列生理活动,例如胰岛素的分泌、神经胶质细胞的迁移分化、神经递质的释放以及心肌和骨骼肌细胞的兴奋收缩耦联等。在心肌细胞节律性的兴奋收缩偶联过程中,钠钙交换体被认为对调控钙瞬流(calcium transient)起到关键作用。在病理条件下,钠钙交换体的活性异常或蛋白表达失调可以导致心衰、心律失常以及中枢神经系统和内分泌系统的病变。
廖军与合作者研究的钠钙交换体(NCX_Mj)来自产甲烷球菌(Methanococcus jannaschii)。在他们以前的工作中(Science(2012) 335, 686-690),研究人员通过分析离子结合中心的结构特征,提出了钠钙相互作用的拮抗模型,来解释交换反应的化学计量学和协同性。在最新的工作中,他们分析了离子结合中心被Na+、Ca2+或锶离子(Sr2+)结合的多种状态,以及处于空置状态的钠钙交换体的结构特点。在此基础上,通过分析离子中心与离子的结合模式、构象变化以及相对亲和力的关系,他们揭示出钠钙交换体处于朝外状态时,Na+控制蛋白构象由部分开放转为闭塞的机制,并进一步解释了钠钙交换的化学计量学为何主要是3Na+:1Ca2+,以及为何也可以是2-4Na+:1Ca2+。对NCX_Mj的分子动力学模拟和构象自由能图也独立地验证了不同的离子占据状态下NCX_Mj的结构变化。
自1968年发现钠钙交换体以来,人们对其功能做了大量研究,其中一个重要发现是,钠钙交换体存在下列特性:首先,钠钙交换体有两类阳离子结合位点,第一类可以结合一个Ca2+或1-2个Na+;第二类结合至少一个Na+。其次,钠钙交换体只有在结合了3个Na+时才能实现钠钙交换。廖军与合作者的最新研究工作,从原子水平解释了钠钙交换体的上述特性。
相关文章链接:http://www.nature.com/nsmb/journal/v23/n6/full/nsmb.3230.html
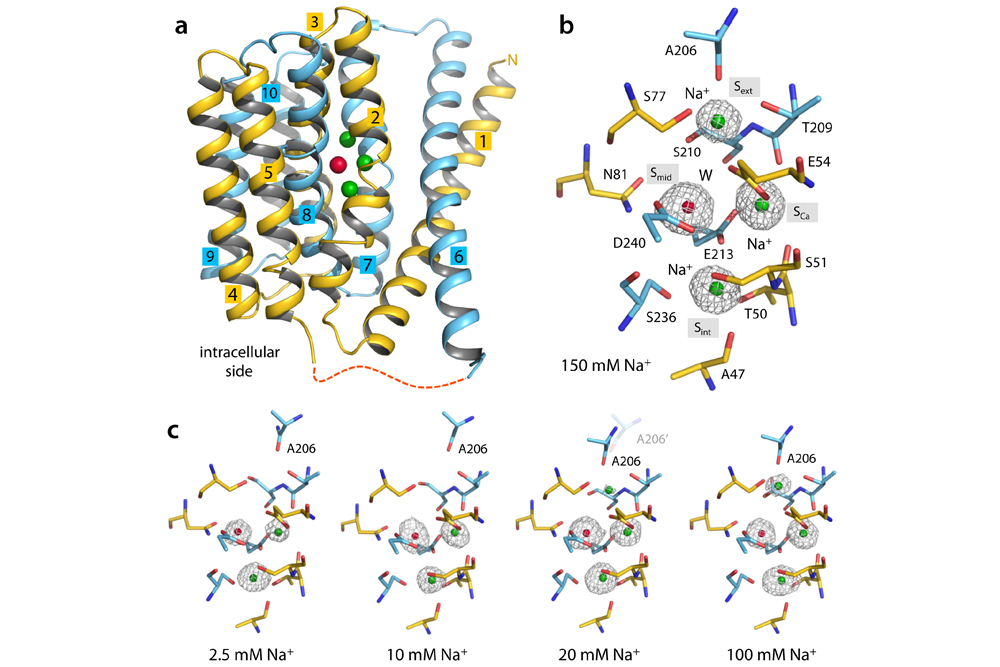
朝外状态的NCX_Mj与Na+的结合

钠钙交换体朝外状态时离子交换的结构机制


