我校生命学院陈佳教授研究组、中国科学院-马普计算生物学研究所研究员(我校生命学院特聘教授)杨力研究组与我校免疫化学研究所副研究员杨贝开展合作研究,开发了一种增强型碱基编辑器(enhanced base editor, eBE),其克服了原有碱基编辑技术保真度较低的缺陷,实现了更高准确度的基因组单碱基编辑。近日,相关成果以“Enhanced base editing by co-expression of free uracil DNA glycosylase inhibitor”为题,在知名学术期刊《细胞研究》(Cell Research)上在线发表。
近年內兴起的CRISPR/Cas9基因编辑技术利用可设计的Cas9核酸酶通过碱基插入、缺失或替换等方式,对生物体基因组DNA特定片段进行改造,进而实现对靶基因的编辑。利用基因组编辑技术对细胞进行遗传学操纵,可广泛的应用于生命科学基础研究、生物技术开发、农业技术开发以及医药研发领域。例如:直接在体内校正引起遗传疾病的基因突变,将能够从根本上治疗遗传疾病;对农作物进行精确的基因工程改造,使其产量提高或能够抵抗环境污染或病原体的感染;对微生物基因组进行精准改造,从而促进可再生生物能源的开发等。
传统的CRISPR/Cas9基因编辑技术虽然具有较高的基因敲除效率,但其在执行碱基替换(譬如对造成遗传疾病的基因突变进行矫正)的效率通常很低,这也限制了CRISPR/Cas9基因编辑工具从科研向应用的全面转化。近期发展出的碱基编辑(base editing)系统,由CRISPR/Cas9和APOBEC胞嘧啶脱氨酶两个独立的体系整合而成,可在基因组靶向位点实现由胞嘧啶向胸腺嘧啶的编辑改造(Komor et al., 2016, Nature)。现有的碱基编辑系统虽然实现了较高的编辑效率,但是同样也伴随着较高水平的非目的性碱基插入或缺失(insertion/deletion, indel)和编辑副产物,这些都显著地降低了碱基编辑器在基础研究和临床上的深入应用。在这项最新的研究中,科研人员在前期对现有碱基编辑器导致非目的性突变机制探索的基础上,成功开发出了增强型基因组碱基编辑器,实现了更高精度和更高效率的碱基编辑,为碱基编辑技术在基础研究及未来临床领域的深入应用提供了新方法和新思路。
陈佳教授长期从事DNA损伤修复引发突变的机制研究,前期工作已揭示APOBEC胞嘧啶脱氨酶在DNA单链断裂修复过程中引发随机突变的新机制。该论文中,陈佳研究组2015级硕博连读研究生王丽洁、杨力研究组研究助理薛尉和免疫化学研究所2017级博士研究生严磊为共同第一作者,陈佳/杨力导师小组成员、生命学院2015级本科生陈苗苗和其他研究组成员为共同作者,陈佳、杨力、杨贝为共同通讯作者。该项研究得到了国家自然科学基金委、科技部、上海市科委和上科大科研启动基金的支持,上科大为第一完成单位。
论文链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr2017111a.html
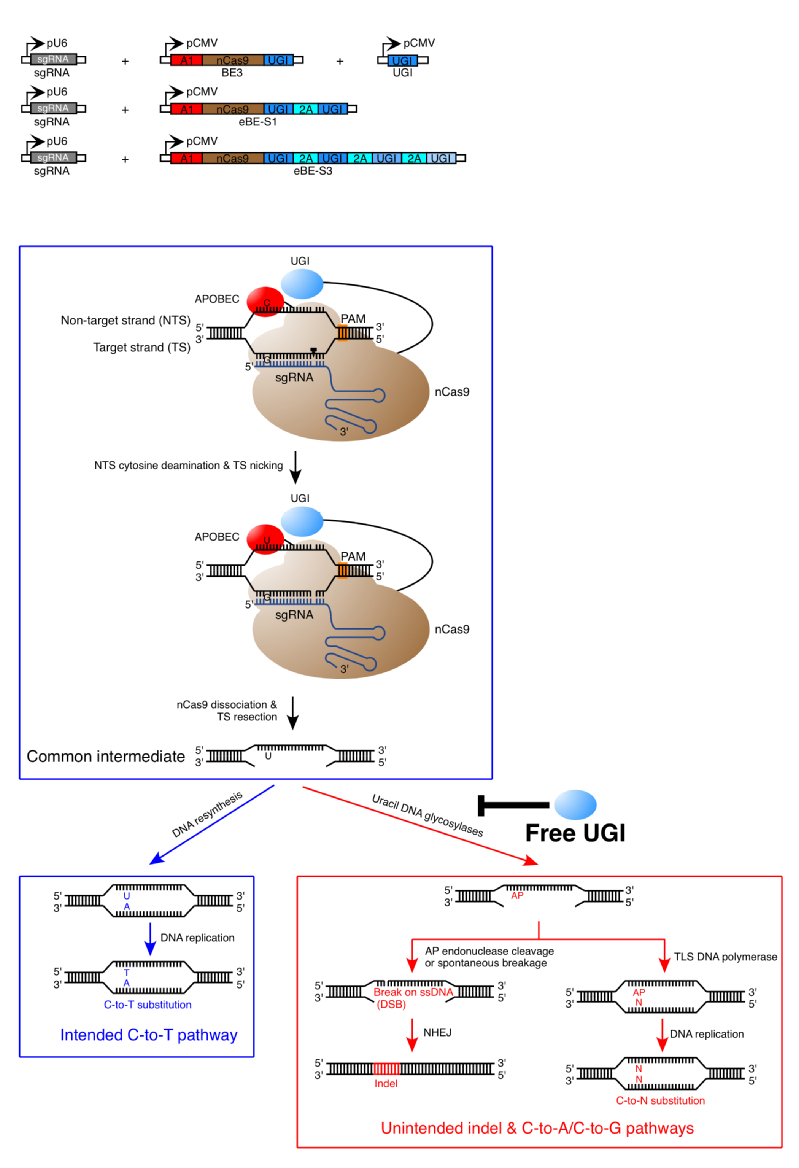
增强型碱基编辑系统以及BE3引发非目的性突变的分子机制


