生命学院黄鹏羽教授课题组与中国科学院神经科学研究所杨辉研究员合作,建立了基于CRISPR/dCas9转基因小鼠的体内基因激活系统,实现了在小鼠脑和肝脏中的多基因同时激活。该体内激活系统的建立,将会为研究神经细胞的转分化以及全基因组基因的转录激活筛选提供重要的平台。1月15日,相关成果以“In vivo simultaneous transcriptional activation of multiple genes in the brain using CRISPR-dCas9-activator transgenic mice”为题,在国际知名学术期刊《自然-神经科学》(Nature Neuroscience)上以Technical Reports的形式在线发表。
基因的体内激活是基础研究和转化医学应用的基础技术之一。但现在常用的基因过表达方法由于技术限制,难以实现长基因,尤其是长链非编码RNA的过表达,也难以实现多基因同时体内过表达。在该研究中,研究者首先开发了一种较以往更加强大的激活系统(SPH),并分别在人和小鼠的细胞里验证了SPH系统的高效性。在此基础上,研究者构建了受Cre重组酶调控的SPH转基因小鼠,进而证明了在SPH小鼠的原代细胞里导入sgRNA和Cre重组酶可以激活基因和长链非编码RNA。为了确定该转基因小鼠在体内实验的有效性,研究者通过尾静脉注射了表达Cre和sgRNA的质粒,发现SPH确实可以在肝脏内高效地激活基因的表达。尤其是在激活了Wnt通路里的关键基因Dkk1后,肝的代谢分区会被改变。为了进一步验证该激活平台是否可以用来研究神经系统的功能,研究者在中脑定点注射了靶向三个转录因子Ascl1,Neurog2以及Neurod1的AAV-sgRNA,结果显示星形胶质细胞可以直接被转化为功能性神经元。
最终,研究者在SPH转基因小鼠脑部定点注射了靶向十个基因或者八个基因加两个长链非编码RNA的AAV-sgRNA阵列,实现了多个基因在神经元内的同时激活。因此,该研究证明了可以利用SPH小鼠在脑内实现复杂基因网络的调节。这也就提供了一个高效的体内上调基因表达的平台,为理解以及治疗多种神经退行性疾病奠定了良好的基础。
该项工作主要由博士后周海波、博士生刘俊来、周昌阳、高妮、饶志平、李贺在杨辉研究员和黄鹏羽教授的共同指导下完成。其中黄鹏羽课题组2014级硕博连读研究生刘俊来为共同第一作者。该工作还得到了中科院神经所张旭研究员、程乐平研究员、徐华泰研究员和神经所基因编辑平台施霖宇博士的大力协助。本工作得到上海科技大学启动经费、中科院战略性先导科技专项、国家高科技研发项目、中国科学院重大突破项目、国家自然科学基金会和中华人民共和国科学技术部等资助。
论文链接:
https://www.nature.com/articles/s41593-017-0060-6
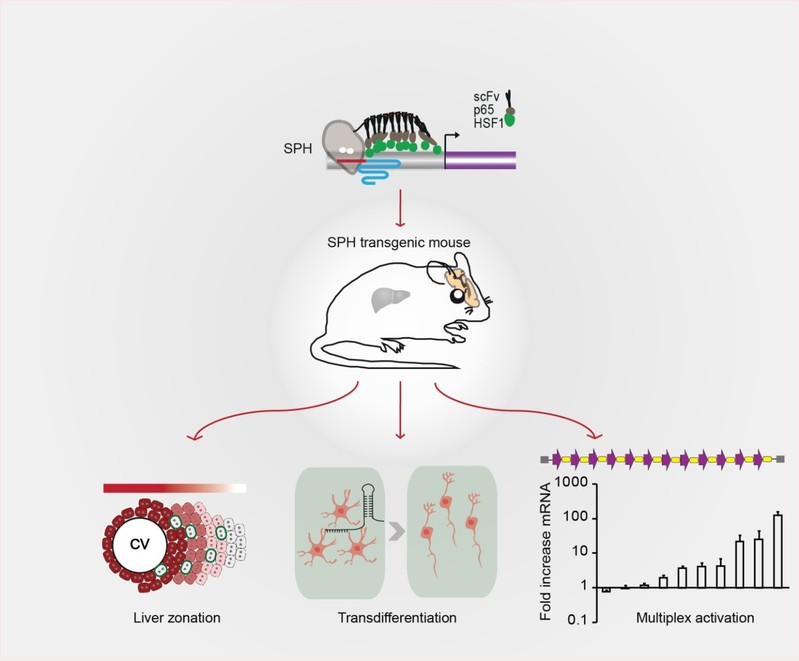
研究总结模式图:该研究首先开发了SPH激活系统并且构建了受Cre重组酶调控的SPH转基因小鼠,研究者证明了该小鼠可以用于改变肝的代谢分区,星型胶质细胞向神经元的直接转分化以及在脑内实现多基因的同时激活。


