近来,以免疫细胞为靶标的肿瘤免疫疗法取得了重大的突破。免疫学家利用大分子药物和细胞药物,来增强病人自身T细胞的抗癌能力,成功地治愈了癌症病人。我们研究团队结合蛋白质组学, CRISPR 筛选以及小鼠遗传学等方法探索T细胞抗肿瘤能力的调节机制,从而开发新型的肿瘤免疫疗法。
作为T细胞疗法的领头羊,CAR-T和TCR-T等工程化 T细胞疗法,已成为治疗癌症的新前沿治疗手段。 CAR-T 和 TCR-T 疗法在细胞持久性和细胞毒性等诸多方面存在差异,导致不同的治疗结果。T细胞抗原受体TCR和 嵌合抗原受体CAR 都识别抗原并触发 T 细胞介导的抗肿瘤反应,但它们具有不同的分子结构和信号传导特性。
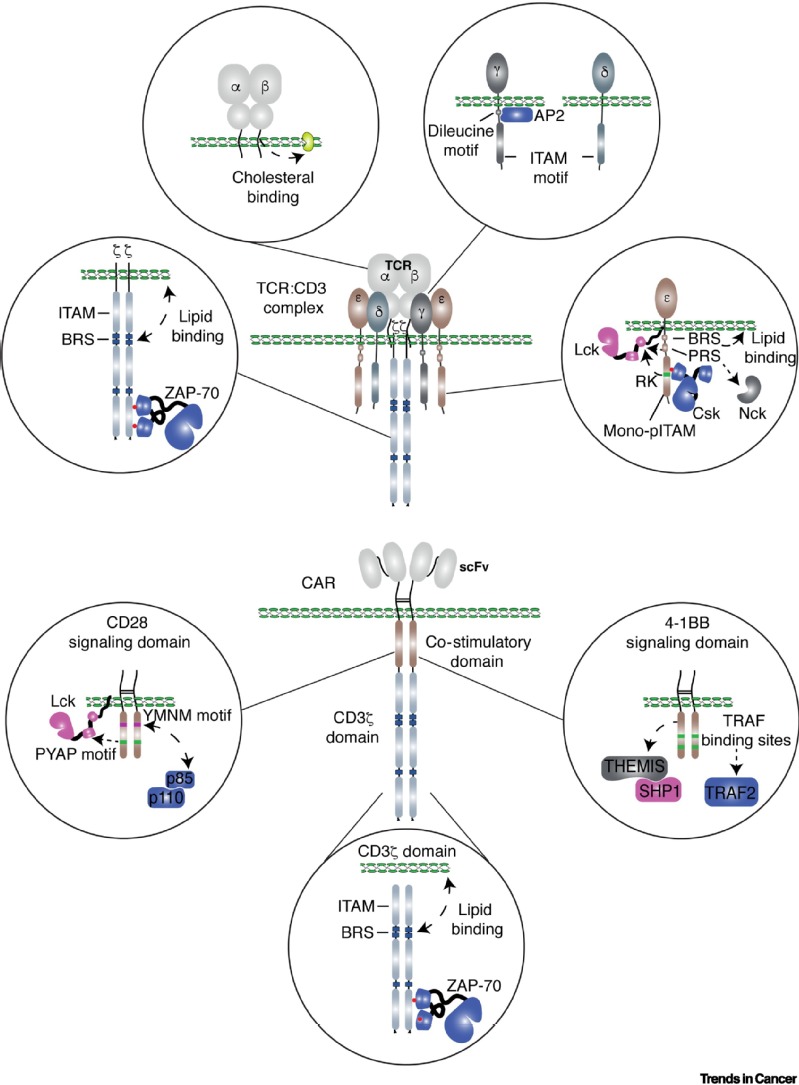
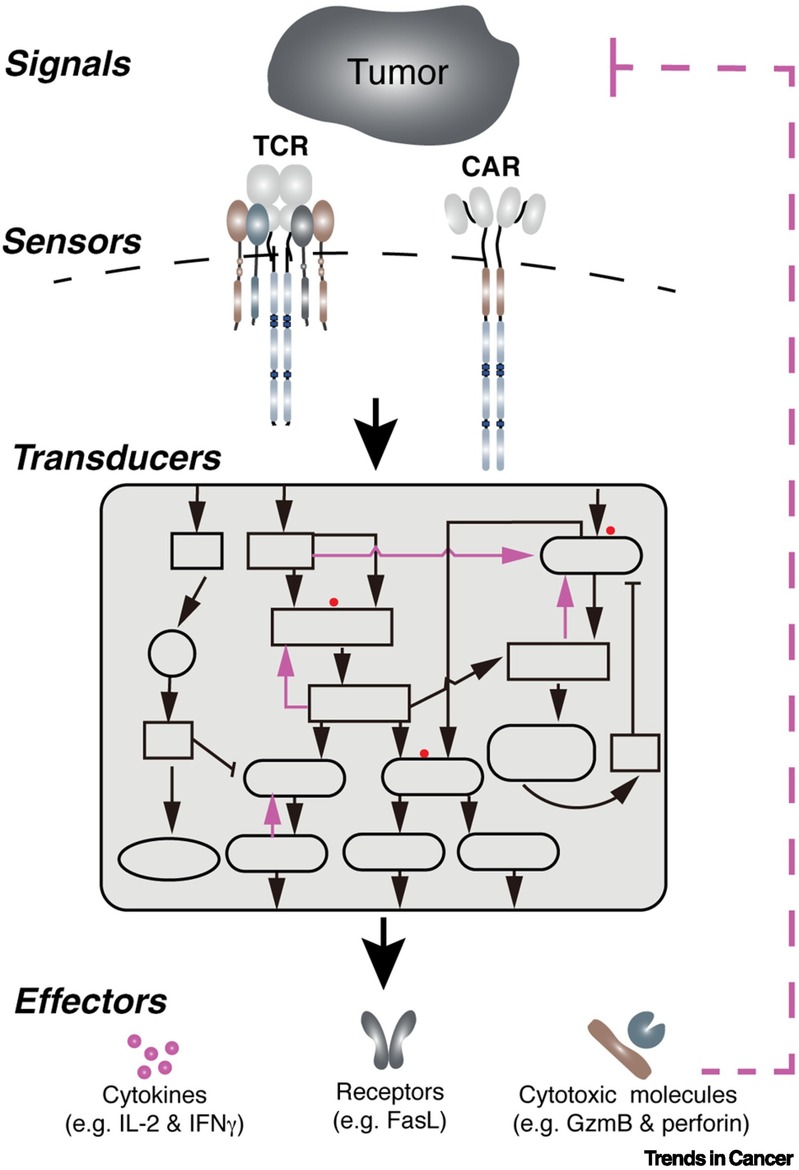
在我们眼里,工程化的T细胞可以看作为是一个信息处理器(an information procerssor)。它可以不断的识别,分类外界的信息,随之快速有效的响应。T 细胞的抗肿瘤反应在可分为三个阶段:i. T细胞膜上的传感元件,如TCR和CAR,扫描周围环境并识别肿瘤细胞上的肿瘤抗原; ii.信息通过信号转导网络被转导放大,激活T细胞 (我们称之为转导元件);三、一系列效应元件被激活或产生以执行抗肿瘤反应(见下图,参见我们的综述Trends in Cancer, 2021)。传感元件、转导元件和效应元件是工程化 T 细胞抗肿瘤反应的重要组成部分。正负反馈回路也参与使这三种成分能够诱导有效和持久的抗肿瘤反应。 TCR-T 和 CAR-T 表现出几个不同的临床特征,包括转移的 T 细胞在体内的持久性、转移到患者体内的 T 细胞数量以及对实体瘤的疗效。这些差异至少部分是由 TCR-T 和 CAR-T 细胞的传感元件和转导元件的不同的特征造成的。了解工程化 T 细胞如何感知肿瘤抗原以及信号网络如何控制 T 细胞抗肿瘤活性将有助于我们开发下一代工程化 T 细胞疗法。因此,我们的实验室专注于优化调节T细胞抗肿瘤功能的传感元件和转导元件以及效应元件。