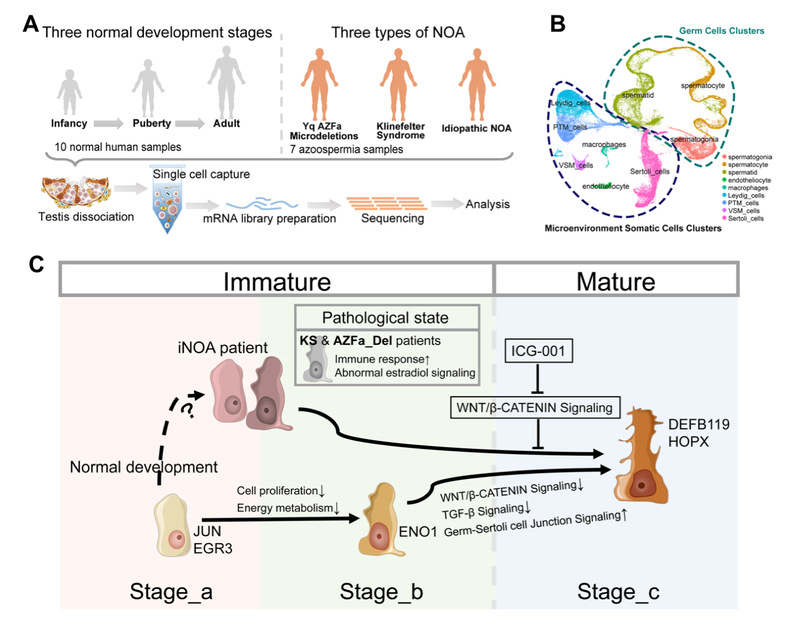
图1:以睾丸生精微环境体细胞发育路径为标尺,阐明了参与微环境构筑的各类细胞发育进程,揭示了不同细胞类型之间的互作网络的动态变化。聚焦于睾丸支持细胞,通过系统地比较正常发育和NOA患者的转录特征,发现了特发性NOA支持细胞谱系退化的特点,并且鉴定了Wnt通路作为诱导其成熟的潜在治疗靶点。

图2:精原干细胞中的stress granule ( SG)的组装和清除对其对抗外源刺激的作用和相关分子机理。睾丸中的生殖细胞为应激敏感细胞,证明快速组装SG 可以有效的防止应激造成的细胞损伤。首次证实泛素化降解途径参与的SG 清除在应激后修复过程中发挥重要作用,该过程对于维持精原干细胞中的基因稳定性也起到关键作用。
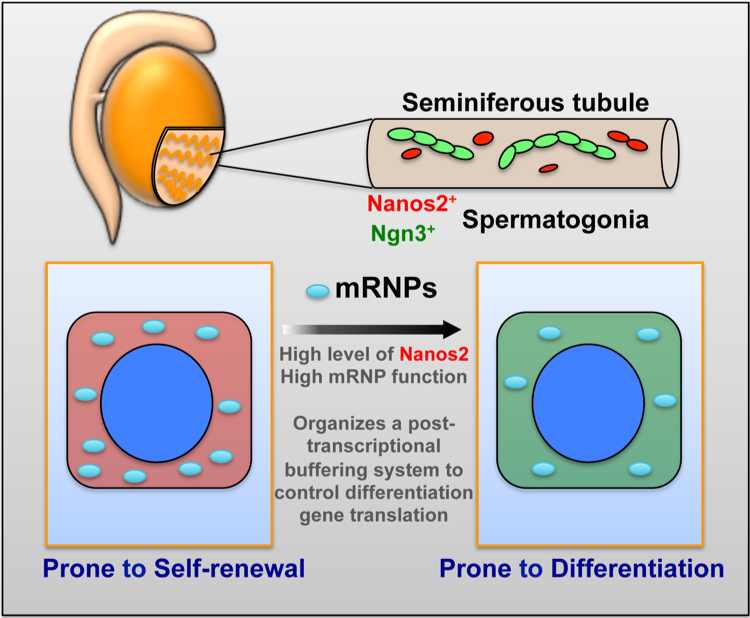
图3:精原干细胞中的P小体是干细胞自我更新和分化稳态缓冲的重要无膜细胞器。哺乳动物精原干细胞高表达RNA结合蛋白Nanos2,其主导组装的P小体通过降解分化相关基因,是细胞维持在原始的干细胞状态。而随着Nanos2降低,参与降解的主要无膜细胞器P小体逐渐解聚,细胞随之分化。


