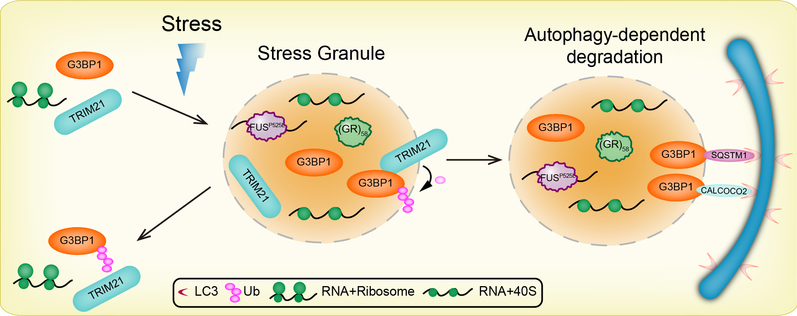
1.应激颗粒是一种由RNA和RNA结合蛋白形成的无膜细胞结构,在细胞受到压力的情况下,通过液液相分离存在于细胞质中。应激颗粒的形成与解聚是高度动态变化的过程,其通过调控细胞内蛋白质翻译和RNA加工的动态平衡以促进细胞在不利条件下存活。应激颗粒与神经退行性疾病如肌萎缩性侧索硬化症等密切相关。我们通过筛选存在于应激颗粒中的蛋白质质量控制因子,发现泛素连接酶TRIM21以及自噬相关蛋白SQSTM1和CALCOCO2能够通过调控应激颗粒的聚集和清除,从而维持应激颗粒在氧化压力条件下的动态平衡。相关工作已发表于:
Stress granule homeostasis is modulated by TRIM21-mediated ubiquitination of G3BP1 and autophagy-dependent elimination of stress granules. Autophagy. 2023.19(7):1934-1951. doi: 10.1080/15548627.2022.2164427.
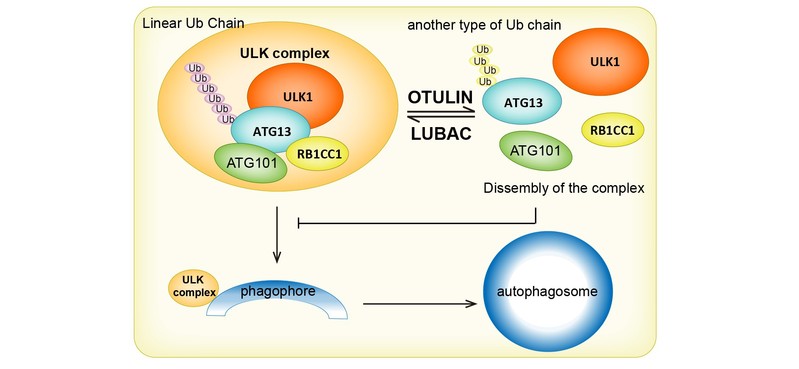
2. 泛素化在细胞自噬的过程中起了非常重要的调控作用。我们通过基于细胞表型的遗传筛选,找到了多个参与自噬的泛素相关蛋白。通过细胞生物学和生物化学等手段,我们对这些泛素连接酶和去泛素化酶的功能进行了分析,找到了他们如何调控自噬的分子机理,相关工作已发表于:
Ubiquitin C-terminal hydrolase L1 regulates autophagy by inhibiting autophagosome formation through its deubiquitinating enzyme activity. Biochem Biophys Res Commun. 2018. 497(2):726-733. doi: 10.1016/j.bbrc.2018.02.140.
LUBAC and OTULIN regulate autophagy initiation and maturation by mediating the linear ubiquitination and the stabilization of ATG13.26 Jun 2020. Autophagy. 2021. 17(7):1684-1699. doi: 10.1080/15548627.2020.1781393.
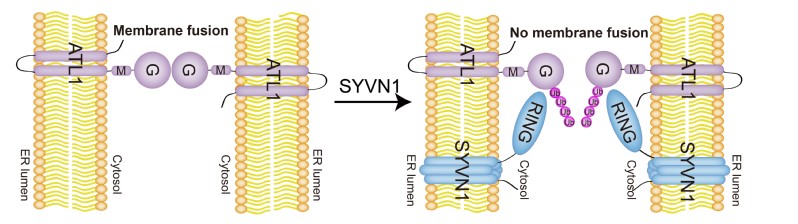
3. 内质网是细胞蛋白质折叠和脂类合成的重要场所。内质网的结构并非一成不变,而是不断处于自我重塑的过程。为了寻找重塑的调控机制,我们筛选了相关因子,发现多个泛素连接酶参与内质网的结构建成和重塑。这些泛素连接酶不仅帮助内质网中错误折叠蛋白的降解,同时也参与内质网自身的形态结构。相关工作已经发表于:
Lunapark is a component of a ubiquitin ligase complex localized to the endoplasmic reticulum three-way junctions. J. Biol. Chem. 2016. 291(35):18252-18262. doi: 10.1074/jbc.M116.737783.
The E3 ubiquitin ligase SYVN1 ubiquitinates Atlastins to remodel the endoplasmic reticulum network. iScience. 2020. 23(9):101494. doi: 10.1016/j.isci.2020.101494.