1. 神经元轴索的物质运输主要由囊泡运输介导,而骨架的稳定性是由节段性骨架结构(MPS)来支撑。我们发现MPS的弹性能够控制囊泡的运输。而该弹性依赖于NM-II活性,其失活会破坏囊泡运输和骨架结构,最终导致轴索退行和神经元死亡。这一发现,揭示了神经元维持结构稳定性的新机理,对其进一步研究,将为创伤性脑损伤和如帕金森氏症(PD)、多发性硬化症(MS)、渐冻人症(ALS)等,在轴索首先发生病变的神经退行性疾病的治疗提供新靶点。这一发现于2020年3月,发表于细胞生物学杂志。 https://rupress.org/jcb/article/219/5/e201902001/151566/Radial-contractility-of-actomyosin-rings
(1) 下面的movie展示了正在经历径向收缩的神经元的轴索,铁轨上枕木一样的小条,是轴索特有的节段性细胞骨架,正是这些骨架的收缩,制约了囊泡的运输,并且决定了轴索的结构的稳定性。
sMov 8 from Wang et al. JCB 2020
(2) 这些快速移动的囊泡,需要‘撑开’制约的轴索径向骨架,才能在极度狭长的轴索中得以快速运输。
sMov 1 from Wang et al. JCB 2020
(3) 而一旦这些大囊泡在狭长轴索中的运输被堵住了,神经元将经历从轴索开始的退行,直到最终凋亡。这是许多至今无解的神经退行性疾病共同的早期病理特征。

Fig.8a from Wang et al. BioRxiv 2019/doi: https://doi.org/10.1101/492959v2
2. 2022年11月22日,祝贺潘小蓉和李捷的文章在 Lab on a Chip(《芯片实验室》)上发表。
(1)我们通过微流控和计算流体力技术建立神经元轴突损伤的芯片(axon-on-a-chip)模型,在体外精准诱导轴突损伤并实时观测纳米级细胞反应。
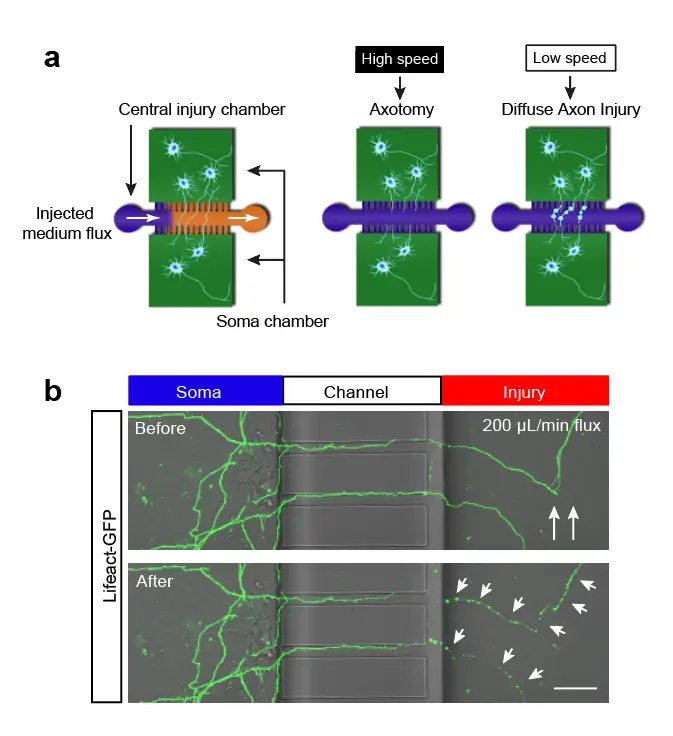
(2)大流速的冲击,会导致神经元的轴突中出现钙离子超载的现象,并且形成无法恢复的肿胀的串珠状结构(如下图所示)。我们认为这种现象模拟了在创伤性脑损伤病人脑中出现的白质中轴突的弥漫损伤的过程。
论文链接:https://doi.org/10.1039/D2LC00730D 新闻链接:https://slst.shanghaitech.edu.cn/2022/1108/c218a965768/page.html
4. 2024年8月4日, 祝贺实验室三位硕士生栾童舒,李晴和黄植的综述文章在中国神经科学学会的会刊《神经科学通报》(Neuroscience Bulletin)上发表。本综述探讨了肌萎缩侧索硬化症(ALS)背后的轴突病变及其治疗见解,讨论了ALS发病分子机制(见下图),并总结了近5年ALS临床治疗进展。
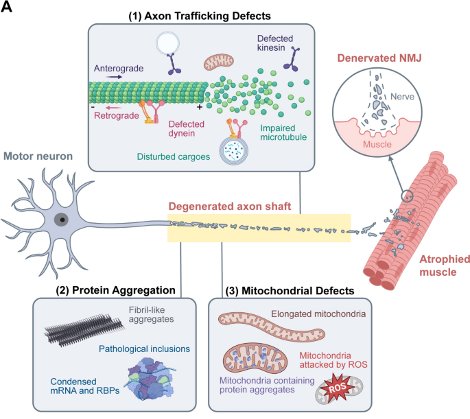
论文链接:https://link.springer.com/article/10.1007/s12264-024-01267-2
3. 2024年8月24日,祝贺实验室潘小蓉和胡一晴同学的文章在在《细胞生物学杂志》(Journal of Cell Biology)上发表,并被选为八月号的封面文章。
(1)我们发现了一种神经元轴突所特有的抵御机械冲击的快速保护机制。此机制使得极度细长的轴突能够承受弱机械力的冲击,而不会轻易退行。
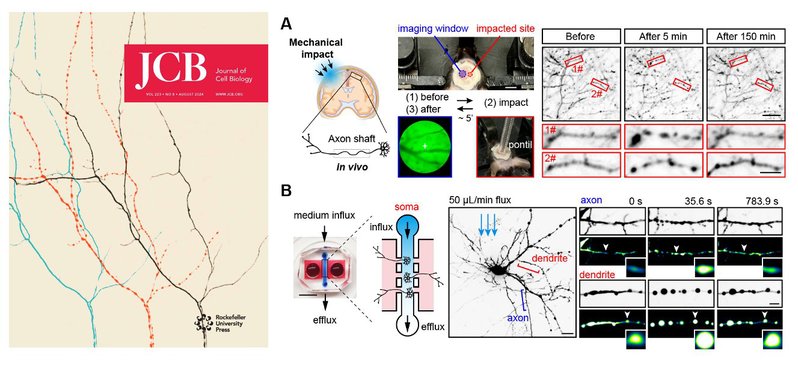
(2)我们利用之前建立的神经元轴突损伤微流控模型对轴突施加精准控制的横向机械力的冲击,发现轴突在受到弱机械压力冲击时会形成可逆的串珠结构(如下图)。
新闻链接:https://www.shanghaitech.edu.cn/2024/0513/c1001a1096315/page.html


