1.基因编辑技术研发与应用
(1) 精准基因组编辑: 虽然Cas9蛋白靶向基因组序列相对精确,但细胞对由此产生的双链断裂的修复并不精确。碱基编辑技术与新一代的先导编辑虽能在靶向位点引入准确的突变,但往往受限于编辑长度影响,且脱氨酶或者逆转录酶的过量表达,对于基因组稳定性来说存在着不可忽视的风险。同源重组作为DNA双链断裂后精准修复的方式,在细胞内发生的频率却相对较低。目前,本课题组正在开发一种简易通用的方法来提高细胞内发生同源重组的比率,从而实现高效率的基因或大片段的敲入,缺失,替换等,并在基因治疗领域发挥重要作用 (Yu et al., 2013, Genetics; Xue et al., 2014, G3; Xiao et al., 2017, Nature Microbiology;Gao et al., 2022, Nucleic Acids Research)。
(2) 表观基因编辑: 不改变基因结构而对基因进行可控的调节(沉默与激活)对研究基因的功能必不可少。传统RNAi效率较高,但脱靶严重;CRISPRi技术效率一般且存在脱靶风险。课题组目前正在开发一种基于非编辑RNA技术的全新基因调控技术,从而可以实现基因原位高效沉默以及最低的脱靶效应 (Xue et al., 2014, G3)。

2.表观遗传学功能及机制
表观遗传学是研究在DNA序列不改变的前提下,环境是如何通过影响基因的工作方式而导致细胞和生物个体行为的改变。
(1) 非编辑RNA(non-coding RNA): 人类只有约2%蛋白质编码基因,而98%的基因组却能编码non-coding RNA,然而他们的生物学功能成为基因组研究领域的“暗物质”。课题组目前正通过动物突变模型研究非编辑RNA的生物学功能,并阐明其对靶基因表达的调控机制 (Gerstein et al., 2014, Nature; Wen et al., 2016, Genome Research)。
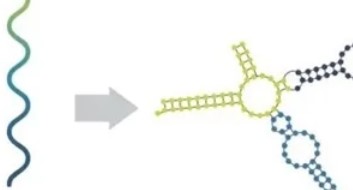
(2) RNA表观修饰: 近年发现,RNA分子上存在约170种共价修饰。RNA修饰可以调控RNA的翻译,改变RNA的稳定性,影响mRNA的代谢与功能,甚至可以直接改变氨基酸的组成。如m6A、m5C、A-to-I、ψ(pseudouridine)修饰等。课题组目前正通过动物模型研究这些新型RNA修饰在动物水平的生物学功能,并阐明其表观修饰与癌细胞转移、干细胞分化、基因组稳定性、免疫方面的关系 (Zhang et al., 2022, Under review)。

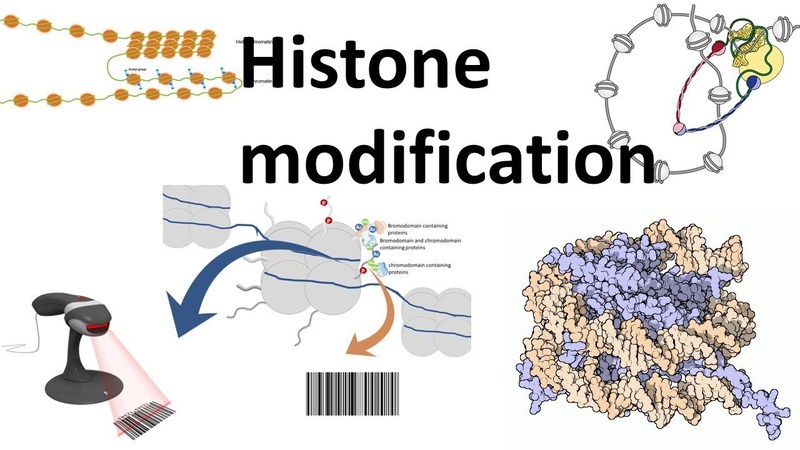
(3) 组蛋白表观修饰: 组蛋白可以通过共价修饰改变染色质的结构从而调控靶基因的表达。课题组目前正通过动物突变体模型研究组蛋白重要位点的甲基化、乙酰化、磷酸化等修饰与动物的发育缺陷、先天免疫、肿瘤的形成和转移、同性恋等社会行为的相关性。并阐明其内在的分子调控机制 (Zhang et al., 2019, Developmental Cell; Zhang et al., 2022, Open Biology; Wang et al., 2022, in preparation)。