6月18日,生命学院Yuu Kimata教授课题组在学术期刊《FEBS Letters》(欧洲生物化学协会联盟通讯)杂志上在线发表题为“Emerging roles of metazoan cell cycle regulators as coordinators of the cell cycle and differentiation”(多细胞动物细胞周期调控因子在细胞周期及分化中的新兴协调角色)的综述论文。
在多细胞动物(包括人类)的发育过程中,细胞的增殖和分化是两大重要的主题。细胞周期的精确调控可以产生适当数目的细胞,并确保组织与器官的生长;而适时的细胞分化可以产生一系列的特化细胞,从而执行不同生理功能。因此,器官与组织的正常形成,必然需要细胞分裂和分化两者的协调。然而,这种协调是如何实现的,目前尚不清楚。一种经典观点认为,分裂和分化的协调是由共同的上游信号通路和转录因子实现的。在这篇综述中,Kimata教授提供了一种新的视角:一些细胞周期调控因子(cell cycle regulators, CCRs)作为细胞分裂的核心调控蛋白,也能发挥一些其他的功能(主要为转录后调控),从而直接影响特定细胞类群的分化。因而,CCRs可以在细胞内发挥分裂-分化双重调控功能,并将二者协调起来。
这篇综述阐述了CCRs如何发挥了这种双重功能,并维持发育过程中的稳态。这些CCRs囊括了细胞周期蛋白依赖性激酶(Cyclin-dependent Kinase, CDK),有丝分裂激酶(mitotic kinases),CDK抑制蛋白(CDK inhibitor, CKI)以及泛素连接酶后期促进复合物(Anaphase-promoting complex/cyclosome, APC/C)与Skp1-Cullin1-F盒蛋白 (Skp1-cullin1-F-box, SCF)。本文列举了许多例子,涵盖了胚胎、特异性的祖细胞或干细胞、以及多能干细胞等。例如,一些CDK和有丝分裂激酶可以调控不对称分裂时细胞命运决定因子的分布,并影响子代细胞的命运;而CDK4/6作为抗癌药物的靶标,则可以直接调节基因转录和信号转导;另外,CKI能通过调控一些干细胞因子表达及相关信号通路活性,影响干细胞的多能性;最后,APC/C和SCF作泛素连接酶,能够靶向作用于转录因子,也可以介导诸多信号通路(包括TGF-β, Wnt, Hedgehog等)中蛋白的降解。这些CCRs在控制细胞周期进程的同时,也参与上述这些过程的调节。文末,Kimata教授提出了一些有待解决的问题,例如CCRs的分裂-分化双重调控功能与疾病的联系,而Kimata教授的团队目前也正在这一领域开展工作。
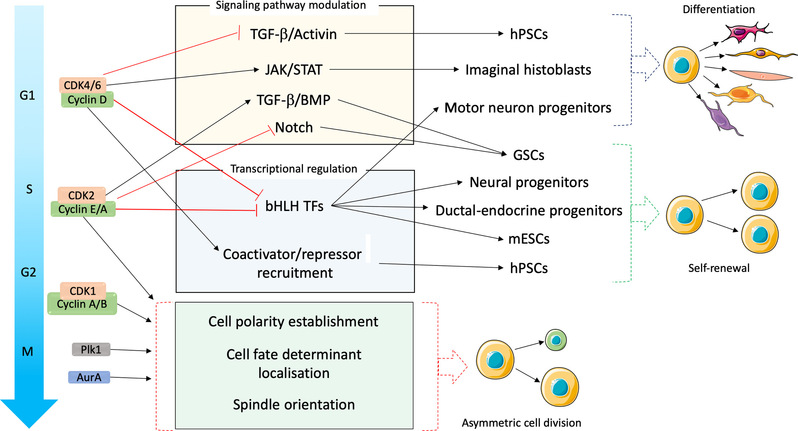
图:细胞周期调控因子在细胞命运决定和细胞分化调节与细胞周期进程相结合中的作用。
Kimata课题组成员博士后MaïtéLeturcq 和合作者Dr. Rajaguru Aradhya也参与了本论文的撰写工作。Kimata实验室目前聚焦于CCRs的非典型功能,关注在细胞命运决定过程中,CCRs对转录调控因子和信号通路的直接调节功能,同时也研究其分裂-分化双重功能在体内是如何被调控的。Kimata教授诚挚欢迎对这一方向有兴趣的有志之士加入团队,一同探索多细胞生物学的奥秘。
论文链接:https://doi.org/10.1002/1873-3468.13805


