6月26日,国际知名学术期刊Autophagy(《自噬》)在线发表了我院刘艳芬课题组关于调控细胞自噬起始的最新研究成果“LUBAC and OTULIN regulate autophagy initiation and maturation by mediating the linear ubiquitination and the stabilization of ATG13”(LUBAC和OTULIN通过线性泛素化修饰和稳定自噬蛋白ATG13调控细胞自噬起始)。
自噬是一种高度保守的细胞降解途径,广泛参与细胞代谢、生存和宿主防御。在饥饿或缺氧等应激压力环境下,细胞形成双层膜结构的自噬体,以包裹受损的细胞器、蛋白聚集体或入侵的病原微生物等。成熟的自噬体通过与溶酶体融合,降解其包裹的内容物,维持内环境稳态。自噬底物的识别,自噬体形成的起始、延伸和成熟阶段,以及自噬体与溶酶体融合的过程都受到严格的调控。ULK1复合物(由ULK1、ATG13、RB1CC1/FIP200和ATG101组成)是调控自噬起始的关键复合物。尽管自噬过程得到广泛研究,但是自噬的起始和成熟是如何被调控的尚不清晰。
线性泛素化是近年新发现的一类多聚泛素连接方式。LUBAC (Linear ubiquitin chain assembly complex)(线性泛素化组装复合物)是目前发现的唯一可以催化线性泛素化的泛素连接酶,OTULIN (OTU deubiquitinase with linear linkage specificity) 是一种特异去除线性泛素链的去泛素化酶。线性泛素化缺陷与多种炎症性疾病密切相关。在本项目中,研究人员发现诱导自噬时,LUBAC和OTULIN可被募集至自噬前体膜上。LUBAC复合物中的泛素连接酶RNF31/HOIP的缺陷导致自噬小体形成受阻,细胞不能有效清除入侵的沙门菌。去泛素化酶OTULIN敲减时,细胞内形成大量自噬前体结构,但自噬体成熟受阻。进一步研究显示,OTULIN敲减时,ULK1复合物核心组分ATG13被过度线性泛素化,且大量累积,并募集至自噬前体结构中,促进自噬体膜的不断延伸,但自噬体成熟受阻。该工作首次报道了线性泛素化自噬相关蛋白参与调控细胞自噬,为研究自噬与炎症性疾病提供了新的思路和靶点。
刘艳芬课题组博士后储元元、研究助理康英锦和2018届毕业硕士研究生严聪为本论文共同第一作者,刘艳芬教授为通讯作者,上海科技大学为第一完成单位。本研究得到分子影像平台和分子细胞平台的大力支持。该研究工作得到了国家自然科学基金委和上科大科研启动基金的支持。
文章链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2020.1781393
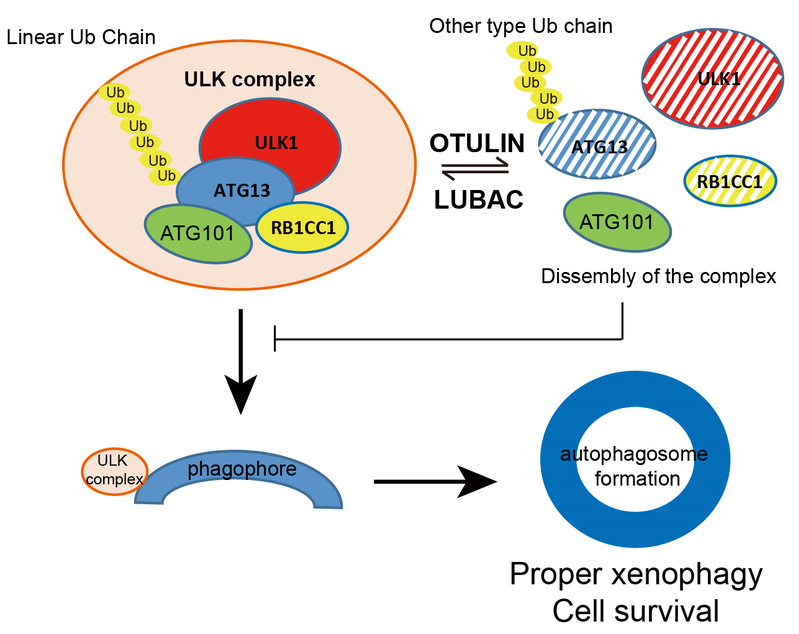
图:LUBAC和OTULIN通过调节ATG13的线性泛素化来调控自噬起始和成熟的模型


