北京时间8月5日,我院王皞鹏课题组联合中科院分子细胞科学卓越创新中心许琛琦实验室、复旦大学附属眼耳鼻喉科医院吴海涛课题组,在《免疫》(Immunity)上以封面文章的形式发表了题为“Chimeric Antigen Receptor Designed to Prevent Ubiquitination and Downregulation Showed Durable Antitumor Efficacy”(具有持久抗肿瘤效果的新型可循环嵌合型抗原受体)的研究论文,提出了一种新型的“可循环CAR”设计方案,显著地提高了CAR-T细胞在体内的持续活性和抗肿瘤效果,为防止CAR-T治疗后的肿瘤复发提供了新策略。

CAR-T疗法是通过在患者自身T细胞上表达嵌合型抗原受体(Chimeric Antigen Receptor, CAR),使其能够识别并杀伤癌症细胞的一种肿瘤免疫疗法。CAR-T疗法已在多种恶性B淋巴肿瘤中展现出令人瞩目的疗效,并且两款CAR-T产品于2017年成功获批上市。然而作为一种新的疗法,CAR-T治疗也有其局限性。临床数据显示,高达30%-50%经CAR-T治疗的病人会出现肿瘤复发的现象,并且大多数患者会在其治疗后一年内出现复发。导致患者肿瘤复发的原因有多种,其中CAR-T细胞的体内持续活性(in vivo persistence),即CAR-T细胞在患者体内存活时间的长短,是一个决定性的因素。在针对急性白血病以及慢性白血病的临床研究中一致发现,CAR-T疗法的疗效与CAR-T细胞在病人体内的持续活性呈正相关性。因此,如何提高CAR-T细胞的持续活性成为当下的研究热点。
在该项研究中,研究人员首次证明了CAR受体在结合肿瘤抗原后会发生泛素化修饰及溶酶体介导的CAR的降解,从而导致细胞表面CAR受体水平显著 下调。研究人员进一步把CAR胞内段的泛素化位点赖氨酸K突变为精氨酸R(CARKR),阻断了CAR的泛素化修饰及溶酶体的降解,抑制了CAR的下调过程。改造后的CAR相较于传统的CAR能够赋予T细胞更强的抗肿瘤效果和持续活性,进一步的机制性探索发现,改造后的CAR在T细胞中循环(recycling),并在激活后富集在胞内内体(endosome)中,其胞内段4-1BB结构域仍然结合着信号传递分子TRAF2,在胞内执行信号传递功能,因而增强了4-1BB下游信号,促进了T细胞的代谢重编程(提高线粒体的生成及氧化磷酸化代谢)及中央型记忆T细胞的分化。研究团队将这种全新的设计命名为可循环CAR(Recyclable CAR)。这些结果为后续可循环CAR的临床验证提供了坚实的基础。
在该项目中,上海科技大学为第一完成单位。上海科技大学博士研究生李文涛、邱士真及复旦大学陈健博士为论文共同第一作者。王皞鹏研究员、许琛琦研究员和吴海涛教授为共同通讯作者。上海科技大学范高峰课题组、南方科技大学田瑞军课题组、北京大学魏平课题组参与研究。本研究得到上海科技大学生命学院分子细胞平台、分子影像平台、生物质谱平台和国家蛋白质科学中心(上海)动物设施的技术支持,并获得国家自然科学基金、国家重点研发计划的经费支持。
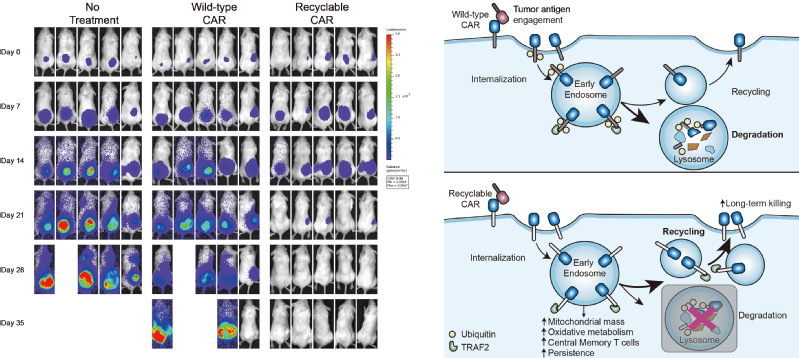
可循环CAR的疗效和机制: 左图:可循环CAR-T细胞高效地清除体内肿瘤。右图:肿瘤抗原的结合导致CAR受体的泛素化修饰,泛素化的CAR受体被运输到溶酶体进行降解;可循环CAR受体不再被溶酶体降解,而是聚集在“内体”中进行信号转导,并且被输送回到CAR-T细胞表面,促进了CAR-T细胞抗癌活性。
论文链接:https://www.sciencedirect.com/science/article/pii/S1074761320303186?via%3Dihub=


