2022年5月4日,上海科技大学生命科学与技术学院罗振革课题组在国际学术期刊eLife杂志在线发表题为“Generation of vascularized brain organoids to study neurovascular interactions”的研究论文,报导了一种全新的类脑器官血管化技术。其建立的血管化类脑器官模型可用于研究脑发育过程中神经、血管及免疫细胞之间的相互作用,也提供了人脑发育与进化,神经系统疾病机理研究及药物筛选的体外模型,有广泛的应用前景。
类脑器官模型是由多能干细胞诱导而来的类脑组织,具有大脑的多种细胞类型及结构功能域,可以部分重现脑组织的结构和功能,甚至疾病发生过程。类脑器官技术是脑科学以及干细胞与再生医学领域前沿技术。血管在大脑发育过程中,在氧气运输、营养物质交换等方面起着重要作用,但是目前诱导的类脑器官中缺乏血管结构,不能完全模拟体内大脑的发育过程及病理特征。因此,类脑器官的血管化是目前该领域亟待解决的重要挑战之一。
在哺乳动物的胚胎发育过程中,大脑起源自神经外胚层,而血管组织起源自中胚层,因此在体外同时诱导两个胚层的产生十分困难。本研究独辟蹊径,先分别诱导两个胚层的类器官,之后在一定时间点将两者融合后共同培养,来实现类脑器官的血管化。
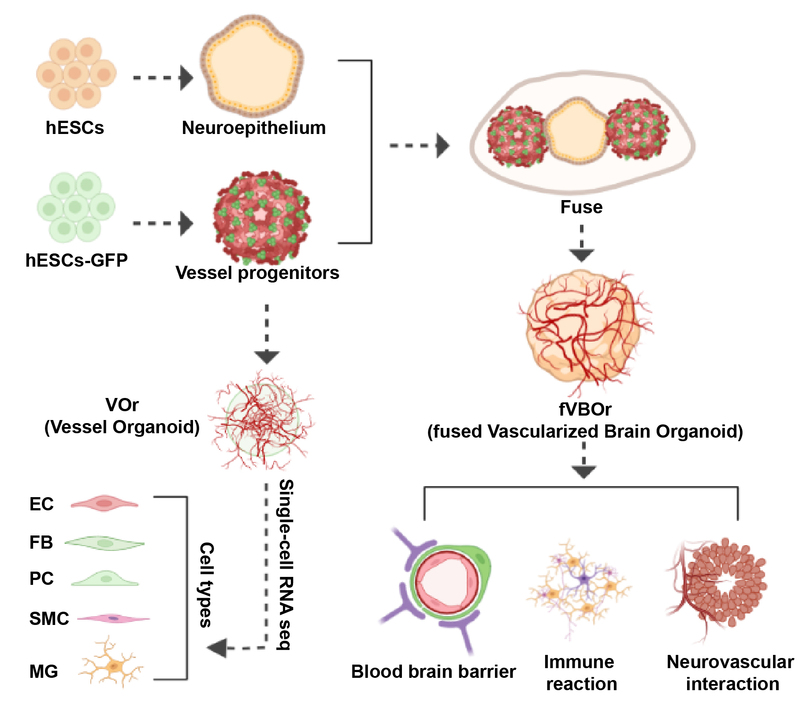
图 | 血管化类器官建立流程
首先,课题组建立了由人胚胎干细胞向中胚层诱导产生血管类器官模型的方法,并在培养后期加入神经营养因子,使其具有脑血管的特征;同时,将人胚胎干细胞向神经外胚层方向诱导产生类脑器官模型;最后,在其分别发育至血管前体细胞和神经前体细胞阶段时将两部分融合,培养在神经营养性的成熟培养基中。培育至第40天左右,血管结构已包裹并侵入整个类器官中,形成完整的血管组织,与神经组织紧密连接。
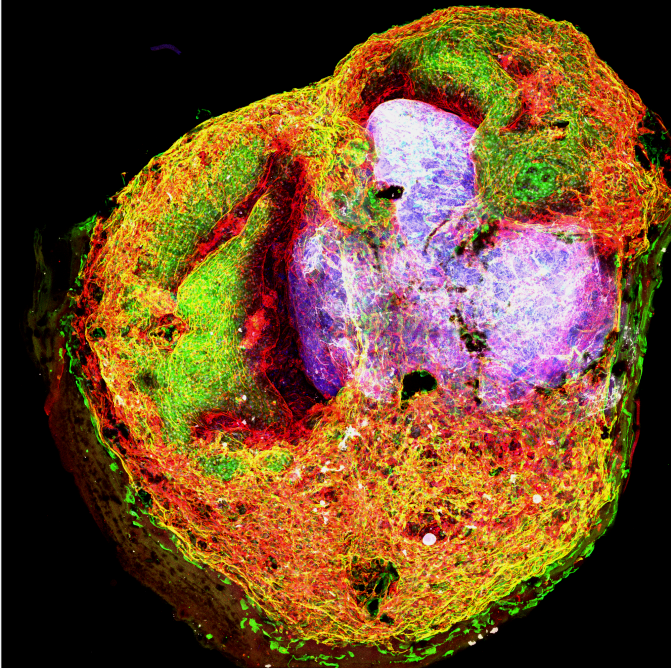
图 |培养至第40天的血管化类脑器官
(DAPI标记细胞核,GFP标记中胚层来源的细胞,CD31标记血管内皮细胞, DCX标记早期神经元)
通过单细胞测序技术,课题组发现血管类器官具有内皮细胞、周细胞、平滑肌细胞、成纤维细胞以及小胶质细胞等几乎所有脑血管相关的细胞类型。通过将测序结果与小鼠及人脑血管数据进行对比,证明其能很好地模拟体内脑血管细胞的分子特征。将血管类器官与脑类器官融合后,血管结构与神经组织形成了紧密连接的血脑屏障结构。有趣的是,融合后血管化类脑器官中引入了大量的小胶质细胞,这些细胞具有免疫应答功能及突触修剪功能。血管结构同时也调控神经发生过程,促进了神经干细胞的增殖,使皮层结构增厚,并在培养后期保护神经元,减少细胞凋亡。血管化类脑器官中的神经元电活性及其成熟度都有显著性增强。
罗振革课题组博士研究生孙新尧、日本冲绳科学技术学院大学居相春博士为本文第一作者,罗振革教授和居相春博士为共同通讯作者。上海科技大学生命科学与技术学院研究生李扬、曾鹏鸣、吴坚、博士后董健,中国科学院脑智卓越创新中心博士研究生周盈盈、陈跃军研究员以及沈溧冰博士也参与了该项工作。上海科技大学为第一完成单位。该研究得到国家科技部科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金重点项目、中国科学院前沿领域重点项目、上海市市级重大专项及科技部重点研发计划项目的资助。
论文链接:
https://elifesciences.org/articles/76707


