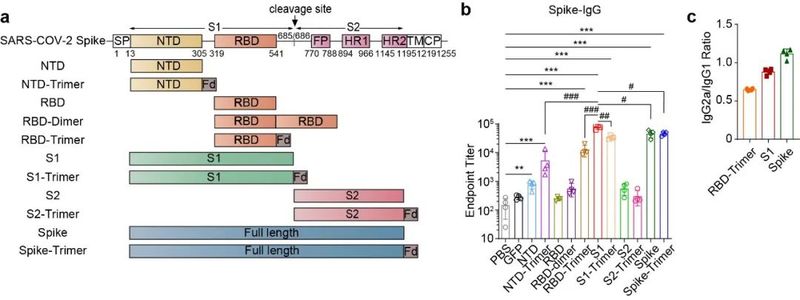
近日,上海科技大学钟桂生课题组与王皞鹏课题组合作在学术期刊Signal Transduction and Targeted Therapy上发表研究论文。该研究利用团队前期优化的新型腺相关病毒(AAV)载体——AAV-ie,开发了基于AAV载体的新型新冠病毒疫苗。COVID-19疫情严重影响人类健康及全球范围内的社会经济生活。据WHO统计,疫情暴发以来,已在全球范围内造成6亿多人感染及600万人死亡。为有效防控疫情,目前已有灭活病毒疫苗、重组蛋白疫苗、腺病毒疫苗及mRNA疫苗等多种新冠病毒疫苗开发并上市。然而,由于传播过程中病毒频繁地突变,导致新冠病毒变异株尤其是目前的主要流行变体omicron,对第一代疫苗产生免疫逃逸。开发高效、安全、广谱的新型疫苗,有效对抗新的病毒变体,仍是疫苗开发的当务之急。在本工作中,联合团队基于新冠病毒spike蛋白的不同结构域,首先设计了一系列候选疫苗,并使用小鼠模型系统考察了不同结构域的免疫原性,发现S1抗原能够诱导最高的spike特异IgG抗体水平,且其诱导的IgG2a与IgG1的比例接近于1,预示该抗原激活较平衡的Th1/Th2免疫应答。基于此,团队选择S1进行后续研究,并将该疫苗命名为AAV-ie-S1。图1. 不同抗原诱导特异性抗体滴度能力及抗体亚型比例
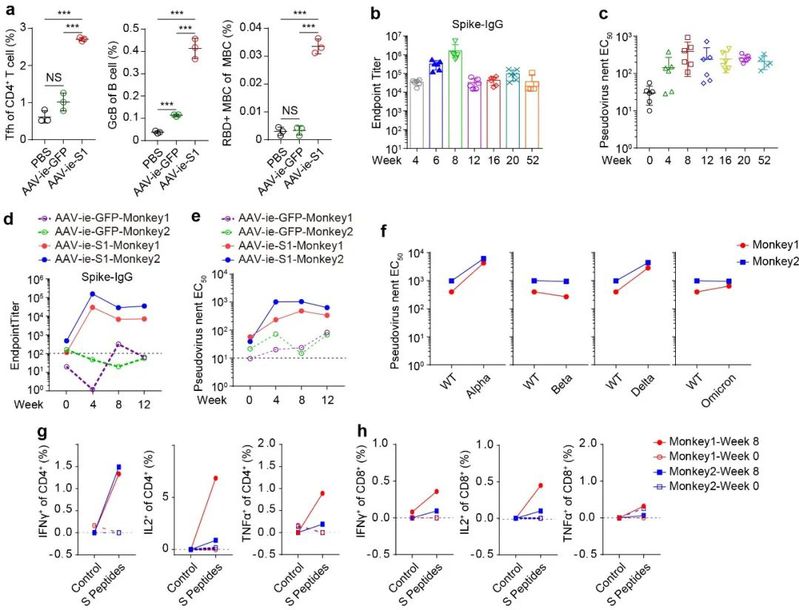
研究团队进一步考察了AAV-ie-S1激活体液免疫与细胞免疫的能力。在小鼠模型中,疫苗免疫后能够显著激活滤泡辅助性T细胞(Tfh)、生发中心B细胞(GcB)细胞的分化并诱导抗原特异性记忆B细胞的产生。并在长达1年的抗体滴度追踪实验中,AAV-ie-S1均诱导了稳定的spike特异IgG抗体滴度及中和活性。在非人灵长类动物模型中,AAV-ie-S1同样能够诱导高水平的spike特异IgG抗体水平,并激活抗原特异性T细胞免疫应答。疫苗免疫血清对不同新冠变体假病毒的中和活力考察结果显示,AAV-ie-S1能够有效中和新冠病毒变体,包括omicron变体。其中,猴免疫血清对omicron的中和活性无明显下降,预示着AAV-ie-S1能够有效避免免疫逃逸。AAV载体疫苗的稳定性实验表明,在室温保存2周后,AAV-ie-S1仍保持稳定。 图2. AAV-ie-S1在不同动物模型中对体液免疫、细胞免疫的激活作用及对不同新冠病毒变体的中和能力
尽管活病毒中和活性及动物体内实验还在进行中,本研究已经提示了AAV载体作为疫苗递送载体的可行性,并验证了AAV载体疫苗高效、安全、稳定及单剂接种等特点。但该疫苗的研发仍处于初期阶段,后续研究团队将继续开展相关实验,验证该疫苗在体内的保护作用。该论文题为“A protective AAV vaccine for SARS-CoV-2”。上海科技大学iHuman研究所副研究员赵思蒙,生命学院2020级研究生柯君子为论文共同第一作者。iHuman研究所研究员、生命学院常任副教授钟桂生与生命学院常任副教授王皞鹏为论文通讯作者。上海科技大学为该论文的第一完成单位。文章链接:
https://www.nature.com/articles/s41392-022-01158-w