了解蛋白质的三维结构是理解其在生物体内发挥功能的基础。近年来,大量的蛋白质结构通过X射线衍射晶体学(X-ray crystallography)和单粒子冷冻电镜(single partile analysis by cryo-electron microscopy, SPA cryo-EM)方法得到解析,AlphaFold的出现和进化更使我们可以不通过实验就可以知道大多数蛋白质的静态结构,这些结构为我们深入了解蛋白质功能提供了重要的线索。然而,在蛋白质功能执行过程中,常表现出复杂的动态变化。而这些动态过程目前仍难以通过X射线衍射晶体学和单粒子冷冻电镜直接揭示。时间分辨串行飞秒晶体学(Time-resolved serial femtosecond XFEL method, TR-SFX)利用XFELs和精密的泵浦-探测(pump-probe)技术,为研究生物大分子的动态结构提供了一种革命性的实验方法(见图 1)。在此技术中,蛋白质微晶体在真空或与高粘度润滑油混合后垂直输出,与水平射出的XFELs交叉,在微晶到达XFELs衍射位置之前,利用激光照射晶体启动反应后,就可以利用XFELs检测反应中间态的结构。此技术特别适用于研究光敏蛋白,其中特定波长的激光作为泵浦源激发样品,XFELs随后作为探测源捕捉结构变化。通过调整泵浦与探测脉冲之间的延迟时间,我们能够在化学反应的不同阶段捕获分子结构的瞬间状态,延迟时间可精确到亚皮秒至毫秒级,使我们可以观察从化学键断裂到底物结合以及复杂催化事件的动态过程。每个时间点的数据分析后将得到该时间点的结构快照。通过收集多个这样的快照,可以构建成一系列连续的图像,称为“分子电影”。这些分子电影提供了对生物化学反应动态过程的深入视角,使我们能够观察并分析反应中发生的连续结构动态变化,为研究提供了前所未有的详细信息。
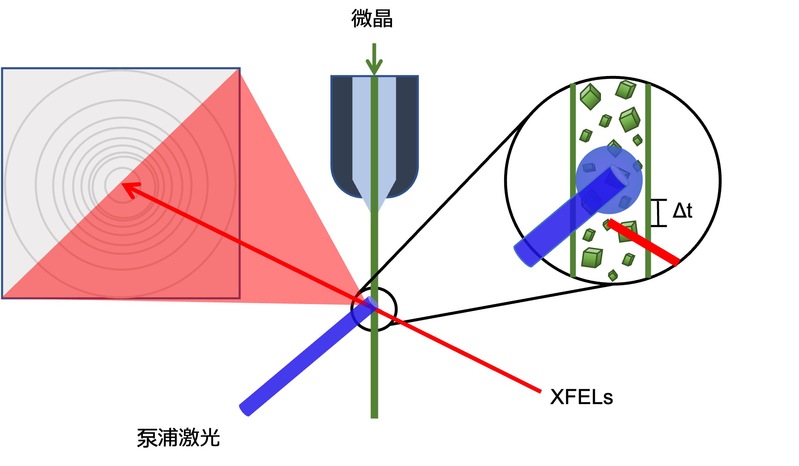
图 1.利用XFELs的泵浦-探测时间分辨串行飞秒晶体学方法示意图


