课题组长
姓名:
王彤助理教授 研究员 博士生导师, PhD, 助理教授
职务:
所在院所:
生命科学与技术学院
荣誉称号:
东方学者,浦江人才,中国神经科学学会-发育与再生分会委员
教育经历:
-
2000/09—2004/06,山东大学,学士
-
2004/09—2011/06,中国科学院神经科学研究所,博士
博士后及工作经历:
- 2011/07—2012/06,中国科学院神经科学研究所,助理研究员
- 2012/06—2016/12,澳大利亚昆士兰脑研究所Clem Jones 老年性痴呆研究中心,UQ科研博士后
- 2017/01—2019/09,澳大利亚昆士兰大学,ACR DECRA研究员
- 2019/09—至今,上海科技大学,生命科学与技术学院,助理教授(TENURE-TRACK)
课题组简介
研究内容:
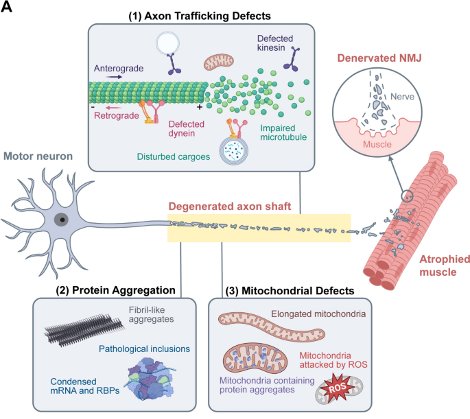
神经元是人体中最长的细胞,而其轴突是占据神经元99%长度的突起,因此是人体全身最长的亚细胞结构:坐骨神经和运动神经元中的轴突长度可以超过一米。轴突在神经网络之间起到连接作用,既可以作为导线传递电信号又作为高速公路介导物质运输。而这样极端的长度,以及活跃的神经活动,令神经元给轴突的充分能量和物质供应成为挑战,因此,轴突是神经元的最脆弱的结构部分,容易在各种压力下收到损伤。在外伤、生理性衰老以及多种神经退行性疾病导致的神经元退行过程中,都是轴突首先退行,然后沿着“dying back”的模式蔓延到胞体,并最终导致整个神经元的死亡。 轴突的损伤将会瘫痪整个神经系统,造成如昏迷,神志不清,瘫痪和认知缺陷等神经系统症状。在创伤性脑损伤(TBI)和神经退行性疾病(例如阿尔茨海默氏病(AD),帕金森氏病(PD),亨廷顿氏病(HD)和以“渐冻人症(ALS)”为代表的运动神经元疾病)病人的中枢神经系统中,广泛存在着轴突的损伤和退行。这些轴突的病理性改变是中枢神经元损伤的极早期标志甚至是起因之一。然而目前,导致轴突损伤和退行的分子和细胞机理仍不明确。而能否通过干预轴突退行这一神经退行的最早期病理,阻止神经退行性疾病的进展,是更加未知的问题。 神经损伤机理实验室成立于2019年7月。主要研究由机械力或遗传因素导致的脑损伤和神经退行的分子机理。我们用多学科相结合的研究手段利用活细胞、超分辨率、单分子等高阶显微镜技术,并结合微流控、计算流体力学和分子生物学,揭示造成活体神经元损伤的分子细胞机理,主要包括囊泡运输和细胞骨架在弥漫性轴索损伤和退行过程中的功能。此外,还将利用微流控芯片技术建立损伤后再生的体外平台,来筛选可以促进神经元损伤后再生的小分子靶点和药物,以期减轻神经损伤和退行。目前实验室进行中的具体项目主要包括:
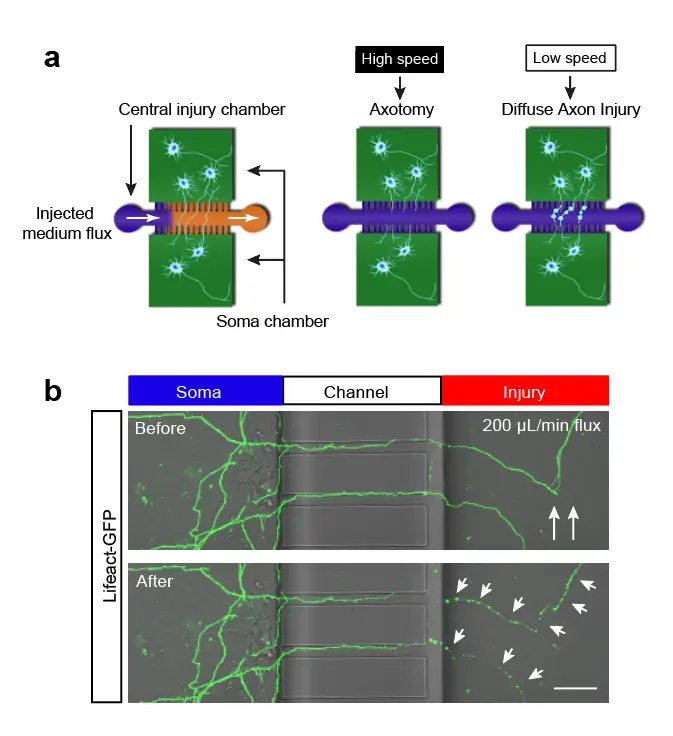
(1)利用微流控技术建立创伤性脑损伤(TBI)的体外模型; 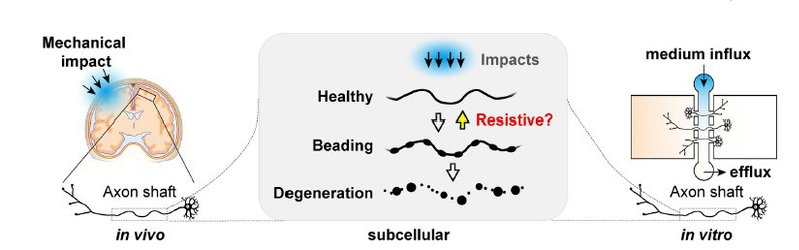
(2)研究轴突逆行运输机制在“渐冻人”症(ALS)病理过程中的功能; 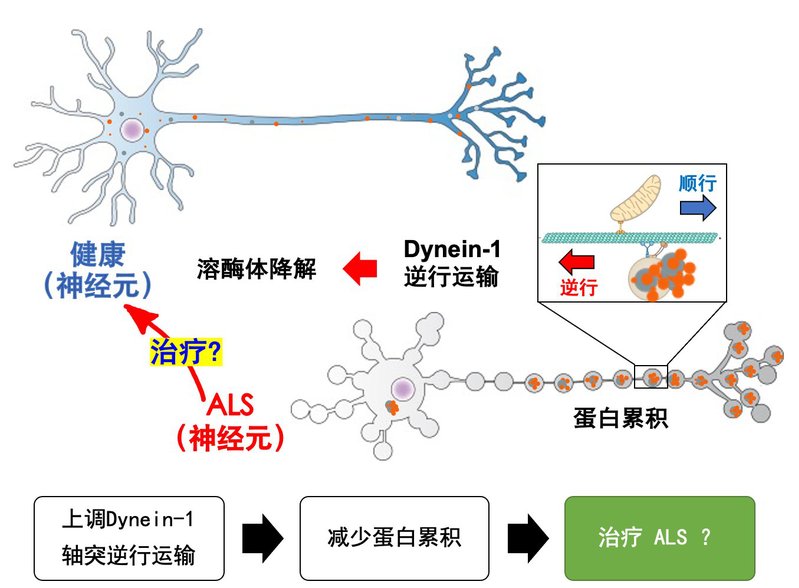
(3)探究神经元轴突线粒体是否具备一些特性以支持其极端的长度和结构稳定性? (4)探究线性泛素化修饰机制在神经元的突触和认知发育过程中的功能。
代表性论文(*第一作者,#通讯作者)
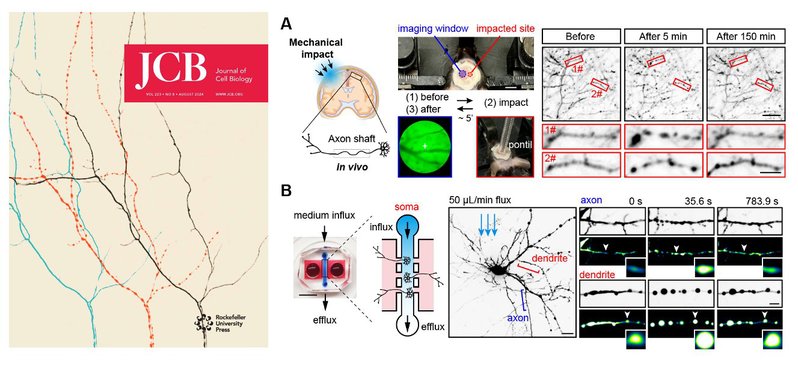
- 1. Pan, Xiaorong*; Hu, Yiqing*; Lei, Gaowei; Wei, Yaxuan; Li, Jie; Luan, Tongshu; Zhang, Yunfan; Chu, Yuanyuan; Feng, Yu; Zhan, Wenrong; Zhao, Chunxia; Meunier, Frederic A.; Liu, Yifan; Li, Yi#; Wang, Tong#; .Actomyosin-II protects axons from degeneration induced by mild mechanical stress.JOURNAL OF CELL BIOLOGY. 07 May 2024. 223(8).
- 2. Luan, Tongshu*; Li, Qing*; Huang, Zhi*; Feng, Yu; Xu, Duo; Zhou, Yujie; Hu, Yiqing; Wang, Tong#; .Axonopathy Underlying Amyotrophic Lateral Sclerosis: Unraveling Complex Pathways and Therapeutic Insights.NEUROSCIENCE BULLETIN. 01 Aug 2024.
- 3. Yang, Cuiwei*; Wang, Zhangshun*; Kang, Yingjin*; Yi, Qianqian; Wang, Tong; Bai, Yun#; Liu, Yanfen#; .Stress granule homeostasis is modulated by TRIM21-mediated ubiquitination of G3BP1 and autophagy-dependent elimination of stress granules.AUTOPHAGY. 2023. 19(7):1934-1951.
- 4. Xiaorong Pan*; Jie Li*; Wei Li; Haofei Wang; Nela Durisic; Zhenyu Li; Yu Feng; Yifan Liu; Chun-Xia Zhao#; Tong Wang#; .Axons-on-a-chip for mimicking non-disruptive diffuse axonal injury underlying traumatic brain injury.LAB ON A CHIP. 24 Oct 2022.
- 5. Pan, Xiaorong*; Zhou, Yimin; Hotulainen, Pirta; Meunier, Frederic A.; Wang, Tong#; .The axonal radial contractility: Structural basis underlying a new form of neural plasticity.BIOESSAYS. Aug 2021. 43(8).
- 6. Wang, Tong##*; Li, Wei; Martin, Sally; Papadopulos, Andreas; Joensuu, Merja; Liu, Chunxia; Jiang, Anmin; Shamsollahi, Golnoosh; Amor, Rumelo; Lanoue, Vanessa; Padmanabhan, Pranesh; Meunier, Frederic A.#; .Radial contractility of actomyosin rings facilitates axonal trafficking and structural stability.JOURNAL OF CELL BIOLOGY. 04 May 2020. 219(5).
- 7. Li, Hui*; Yang, Jie; Tian, Cuiping; Diao, Min; Wang, Quan; Zhao, Simeng; Li, Shanshan; Tan, Fangzhi; Hua, Tian; Qin, Ya; Lin, Chao-Po; Deska-Gauthier, Dylan; Thompson, Garth J.; Zhang, Ying; Shui, Wenqing; Liu, Zhi-Jie; Wang, Tong; Zhong, Guisheng#; .Organized cannabinoid receptor distribution in neurons revealed by super-resolution fluorescence imaging.NATURE COMMUNICATIONS. 2020. 11(1):5699.
- 8. Wang, Hao-Fei*; Liu, Yun; Wang, Tong; Yang, Guangze; Zeng, Bijun; Zhao, Chun-Xia#; .Tumor-Microenvironment-on-a-Chip for Evaluating Nanoparticle-Loaded Macrophages for Drug Delivery.ACS BIOMATERIALS SCIENCE & ENGINEERING. Sep 2020. 6(9):5040-5050.
- 9. Martinez-Marmol, Ramon*; Mohannak, Nika; Qian, Lei; Wang, Tong; Gormal, Rachel S.; Ruitenberg, Marc J.; Vanhaesebroeck, Bart; Coulson, Elizabeth J.#; Meunier, Frederic A.#; .p110 delta PI3-Kinase Inhibition Perturbs APP and TNF alpha Trafficking, Reduces Plaque Burden, Dampens Neuroinflammation, and Prevents Cognitive Decline in an Alzheimer's Disease Mouse Model.JOURNAL OF NEUROSCIENCE. 2019. 39(40):7976-7991.
- 10. Wang, Tong **; Martin, Sally **; Nguyen, Tam H.; Harper, Callista B.; Gormal, Rachel S.; Martinez-Marmol, Ramon; Karunanithi, Shanker; Coulson, Elizabeth J.; Glass, Nick R.; Cooper-White, Justin J.; van Swinderen, Bruno; Meunier, Frederic A.#; .Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB.NATURE COMMUNICATIONS. 2016. 7.
- 11. Harper, Callista B.*; Papadopulos, Andreas; Martin, Sally; Matthews, Daniel R.; Morgan, Garry P.; Nguyen, Tam H.; Wang, Tong; Nair, Deepak; Choquet, Daniel; Meunier, Frederic A.#; .Botulinum neurotoxin type-A enters a non-recycling pool of synaptic vesicles.SCIENTIFIC REPORTS. 2016. 6.
- 12. Narayana, Vinod K.*; Tomatis, Vanesa M.; Wang, Tong; Kvaskoff, David#; Meunier, Frederic A.#; .Profiling of Free Fatty Acids Using Stable Isotope Tagging Uncovers a Role for Saturated Fatty Acids in Neuroexocytosis.CHEMISTRY & BIOLOGY. 2015. 22(11):1552-1561.
- 13. Wang, Tong **; Martin, Sally; Papadopulos, Andreas; Harper, Callista B.; Mavlyutov, Timur A.; Niranjan, Dhevahi; Glass, Nick R.; Cooper-White, Justin J.; Sibarita, Jean-Baptiste; Choquet, Daniel; Davletov, Bazbek; Meunier, Frederic A.#; .Control of Autophagosome Axonal Retrograde Flux by Presynaptic Activity Unveiled Using Botulinum Neurotoxin Type A.JOURNAL OF NEUROSCIENCE. 2015. 35(15):6179-6194.
- 14. Xu, Xiao-Hui*; Deng, Cai-Yun*; Liu, Yang; He, Miao; Peng, Jian; Wang, Tong; Yuan, Lei; Zheng, Zhi-Sheng; Blackshear, Perry J.; Luo, Zhen-Ge#; .MARCKS regulates membrane targeting of Rab10 vesicles to promote axon development.CELL RESEARCH. May 2014. 24(5):576-594.
- 15. Liu, Yang*; Xu, Xiao-Hui; Chen, Qi; Wang, Tong; Deng, Cai-Yun; Song, Bao-Liang; Du, Jiu-Lin; Luo, Zhen-Ge#; .Myosin Vb controls biogenesis of post-Golgi Rab10 carriers during axon development.NATURE COMMUNICATIONS. 2013. 4:2005.
- 16. Wang, Tong **; Liu, Yang **; Xu, Xiao-Hui; Deng, Cai-Yun; Wu, Kong-Yan; Zhu, Ji; Fu, Xiu-Qing; He, Miao; Luo, Zhen-Ge#; .Lgl1 Activation of Rab10 Promotes Axonal Membrane Trafficking Underlying Neuronal Polarization.DEVELOPMENTAL CELL. 2011. 21(3):431-444.
- 17. Wang, Jia*; Fu, Xiu-Qing; Lei, Wen-Liang; Wang, Tong; Sheng, Ai-Li; Luo, Zhen-Ge#; .Nuclear Factor kappa B Controls Acetylcholine Receptor Clustering at the Neuromuscular Junction.JOURNAL OF NEUROSCIENCE. 2010. 30(33):11104-11113.
- 18. Zhang, Xian*; Zhu, Ji*; Yang, Guo-Ying*; Wang, Qing-Jie*; Qian, Lei; Chen, Yan-Min; Chen, Fei; Tao, Yu; Hu, Han-Song; Wang, Tong; Luo, Zhen-Ge#; .Dishevelled promotes axon differentiation by regulating atypical protein kinase C.NATURE CELL BIOLOGY. 2007. 9(7):743.
专著
Book Chapter 1. Wang, T., and F. A. Meunier. Live-Cell Superresolution Imaging of Retrograde Axonal Trafficking Using Pulse-Chase Labeling in Cultured Hippocampal Neurons. Methods Mol Biol. 2473 (2022): 101-28. https://dx.doi.org/10.1007/978-1-0716-2209-4_9.
项目
-
1. 肿瘤抑制分子Lethal Giant Larvae 1 (Lgl1) 促进中枢神经元轴突损伤后再生,国家自然科学基金面上项目,项目负责人
-
2. 神经元囊泡的长距离逆⾏运输(Retrograde trafficking)在神经退⾏性疾病中的功能研究。,上海市科学技术委员会、上海市人力资源和社会保障局,项目负责人
-
3. 利⽤微流控芯⽚对创伤性脑损伤分⼦机理的研究,上海市科学技术委员会,项目负责人
-
4. 中枢神经元的轴突抵抗机械力引起的损伤和退行的内在分子机理,国家自然科学基金面上项目,项目负责人
奖励
- 1. 2013-2015年,澳大利亚昆士兰大学,UQ Postdoctoral Research Fellowship
- 2. 2016年,澳大利亚昆士兰脑研究所, 年度最佳论文发表奖
- 3. 2017年,Australian Academy of Science, J G Russell Award;澳大利亚科学院,J G 罗素奖
- 4. 2017-2019年,Australian Research Council, Discovery Early Career Researcher Award (ARC DECRA);澳大利亚科研理事会,发现早期职业研究员奖
- 5. 2020年,东方学者
- 6. 2020,浦江人才
加入我们
欢迎对神经系统损伤、退行、发育和再生感兴趣的研究生和本科生同学加入我们,特别号召男同学的加入!
课题组成员及合影
-
姓名:冯妤
身份:硕士研究生
在组时间:2020/3-至今
邮箱:
-
姓名:潘小蓉
身份:硕士研究生
在组时间:2020/03-至今
邮箱:
-
姓名:储元元
身份:助理研究员
在组时间:2020/09-至今
邮箱:
-
姓名:栾童舒
身份:博士研究生
在组时间:2021/03-至今
邮箱:
-
姓名:胡一晴
身份:博士研究生
在组时间:2022.01-至今
邮箱:
-
姓名:徐逸雯
身份:博士研究生
在组时间:2021.09-至今
邮箱:
-
姓名:黄植
身份:博士研究生
在组时间:2023.03-至今
邮箱:
-
姓名:周玉洁
身份:本科生
在组时间:2022.01-至今
邮箱:
-
姓名:许多
身份:本科生
在组时间:2022.07-至今
邮箱:
-
姓名:李晴
身份:博士研究生
在组时间:2023/01-至今
邮箱:liqing2022@shanghaitech.edu.cn
-
姓名:王薇
身份:硕士研究生
在组时间:2024.1-至今
邮箱:wangwei2023@shanghaitech.edu.cn
-
姓名:黄馨颍
身份:硕士研究生
在组时间:2024.1-至今
邮箱:huangxy12023@shanghaitech.edu.cn
2020-08-24, 3:00 PM, 第一次Lab集体照。 
2021年5月,实验室合影 

2023年5月,祝贺陈同学张同学顺利通过毕业答辩! 
2023年7月,祝贺罗同学和李同学顺利通过毕业答辩!

2023年8月,和储博士潘同学一起参加珠海的中国神经科学年会。

2024年12月9日,实验室成员合影。 
|